PUBMED ОБЗОР: Витилиго - "болезнь белых пятен". Гипотезы возникновения и методы лечения
Витилиго — это аутоиммунное приобретенное хроническое заболевание кожи, характеризующееся появлением белых пятен, возникающих в результате повреждения и потери меланоцитов.
Депигментация может прогрессировать на протяжении всей жизни человека, особенно в случае генерализованного витилиго. Пациенты с витилиго, особенно с темным цветом кожи, имеют сниженное качество жизни и серьезные негативные последствия для социальной жизни. С общей частотой от 0,5% до 2% у взрослых и детей во всем мире витилиго является наиболее распространенной причиной депигментации кожи. Оба пола подвержены влиянию болезни в равной степени, хотя пациенты женского пола обычно чаще обращаются за медицинской помощью, возможно, из-за более сильного негативного воздействия со стороны общества, чем мужчины и мальчики. У почти четверти страдающих витилиго заболевание проявляется в возрасте до 10 лет, у 50% до 20 лет и у 70–80% до 30 лет.
Международный консенсус в 2011 году признал несегментарное и сегментарное витилиго двумя основными типами заболевания. Было решено использовать термин «витилиго» для обозначения всех несегментарных типов витилиго. Одним из наиболее важных решений консенсуса было отделение сегментарного витилиго от других форм заболевания, особенно из-за прогностических последствий
Сегментарное витилиго представляет собой один или несколько участков депигментированной кожи, как правило, только на одной стороне тела, например, на лице, шее, туловище, руках или ногах, в детстве и обычно стабилизируется в течение нескольких лет.
Несегментарное витилиго представляет собой хроническую и прогрессирующую потерю меланина с четко очерченными белыми пятнами в центре нормально пигментированной кожи, увеличивающимися со временем в размерах и расположенными на руках, подмышках, веках, ушах, коленях и лодыжках, прогрессирование которых непредсказуемый.
Витилиго обычно связано с различными аутоиммунными заболеваниями, такими как заболевания щитовидной железы, сахарный диабет, волчанка, воспалительные заболевания кишечника, псориаз и атопический дерматит среди прочих. Другие авторы также наблюдали метаболические сопутствующие заболевания, психологические и психические расстройства.
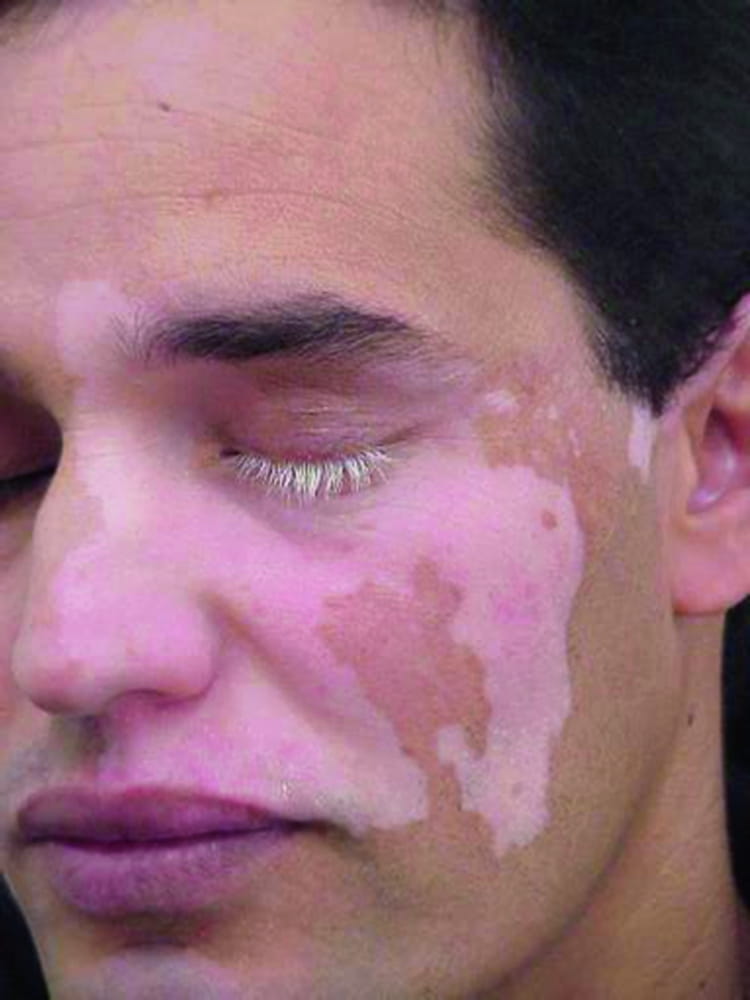
Рисунок 1. Сегментарное витилиго на лице. © Springer Science+Business Media
ПАТОГЕНЕЗ ВИТИЛИГО [2]
Витилиго — многофакторное заболевание, характеризующееся разрушением функциональных эпидермальных меланоцитов.
Точная этиология и патофизиология сложны, и до сих пор ведется много споров о различных теориях потери функции меланоцитов. Было предложено несколько патофизиологических механизмов, включая генетику, аутоиммунитет, окислительный стресс и дисфункцию неврологической системы. Таким образом, разные фенотипы витилиго не могут быть объяснены только одним из этих механизмов, и разные механизмы могут формировать один и тот же клинический результат.
Поэтому была предложена теория конвергенции, объединяющая все существующие теории в комплексную, в которой несколько механизмов способствуют снижению жизнеспособности меланоцитов.
Хотя каждая из этих патогенетических гипотез все еще обсуждается, в настоящее время существует согласие в отношении теорий аутоиммунного и окислительного стресса как ведущих процессов в патогенезе витилиго.
Патогенетические механизмы витилиго показаны на рис. 2
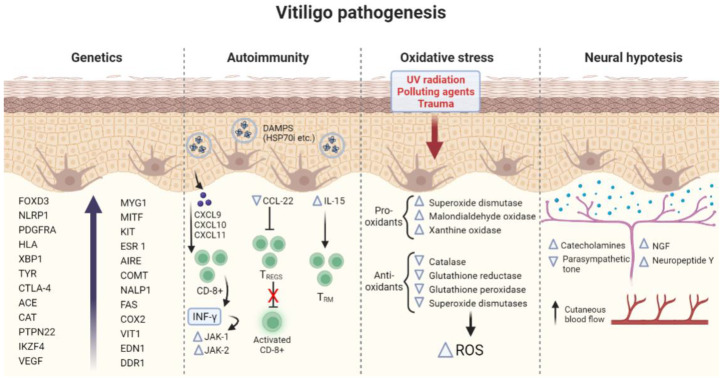
Рисунок 2. Резюме основных патогенетических механизмов, вовлеченных в витилиго. FOXD3 (Forkhead Box D3), NLRP1 (пириновый домен семейства NLR), PDGFRA (рецептор тромбоцитарного фактора роста альфа), HLA (человеческий лейкоцитарный антиген), XBP1 (X-box-связывающий белок 1), TYR (тирозиназа), CTLA- 4 (гликопротеин цитотоксических T-лимфоцитов 4), ACE (ангиотензин-превращающий фермент), CAT (каталаза), PTPN22 (протеинтирозинфосфатаза 22), IKZF4 (цинковый палец семейства IKAROS 4), VEGF (фактор роста эндотелия сосудов), MYG1 (ген пролиферации меланоцитов 1), MITF (Микрофтальмия-ассоциированный фактор транскрипции ), KIT (протоонкоген), ESR 1 (рецептор эстрогена 1), AIRE (аутоиммунный регулятор), COMT (катехол-О-метилтрансфераза), NALP1 (кодирует ключевой регулятор системы врожденного иммунитета, который стимулирует опосредуемые интерлейкином-1-бета воспалительные и апоптотические пути патогенеза в ответ на неизвестные бактериальные или вирусные триггеры)
Генетическая гипотеза
Убедительные данные многочисленных исследований подтверждают многофакторное полигенное наследование витилиго. По оценкам ученых, генетические факторы и факторы окружающей среды несут в себе риск около 80% и 20% соответственно. Несколько эпидемиологических исследований витилиго показали, что это заболевание может наследоваться внутри одной семьи. Таким образом, около 20% пациентов сообщают, по крайней мере, об одном пораженном родственнике первой степени родства, а уровень конкордантности у монозиготных близнецов составляет около 23%.
Распространенные генетические варианты (частота встречаемости аллеля, ассоциированного с болезнью > 0,01) представляют около 71% общей наследуемости витилиго и около 53% общего риска витилиго.
Анализ последовательности ДНК является лучшим ресурсом для понимания сложного полигенного наследования витилиго. Сегодня полногеномный поиск ассоциаций (GWAS), проведенный в популяциях Европы и Азии, выявили по крайней мере 54 локуса восприимчивости к витилиго. Большинство из них участвует в регуляции иммунной системы; распознавании и апоптозе меланоцитов; а также ассоциированы с другими аутоиммунными заболеваниями, такими как заболевания щитовидной железы, диабета 1 типа и ревматоидного артрита.
Исключение составляет ген TYR, который кодирует тирозиназу, ключевой фермент синтеза меланина, который был обнаружен в GWAS, проведенном на европейских белых людях с несегментарным витилиго.
Полногеномный анализ сцепления выявил семь предполагаемых локусов предрасположенности к витилиго, пять из которых были связаны с генами: FOXD3 (Forkhead Box D3), NLRP1 (пириновый домен семейства NLR), PDGFRA (рецептор тромбоцитарного фактора роста альфа), HLA (человеческий лейкоцитарный антиген) и XBP1 (X-box-связывающий белок 1).
Мутации FOXD3, приводящие к усилению транскрипции, по-видимому, мешают дифференцировке меланобластов. NLRP1 является ключевым регулятором врожденной иммунной системы, особенно в коже, где в ответ на специфические триггеры он активирует инфламмасому и превращает про-интерлейкин- бета (IL-β) в его активную форму (IL1β), которая регулирует поляризацию Т-клетки к Th17, таким образом поддерживая воспалительную реакцию.
Хотя при витилиго, как и при других заболеваниях, имеющих аутоиммунный компонент, установлено наличие клеток Th17 и высокий уровень IL-17, роль этих клеток в патогенезе заболевания до сих пор неясна.
Ген PDGFRA играет существенную роль в дифференцировке и выживании меланоцитов во время эмбрионального развития и в регуляции пигментации и связан с дефектной миграцией меланоцитов.
XBP1 является фактором транскрипции, который может влиять на развитие витилиго посредством взаимодействия с молекулами HLA-DR.
Многие другие гены вовлечены в патогенез витилиго, такие как CTLA-4 (гликопротеин цитотоксических T-лимфоцитов 4), ACE (ангиотензин-превращающий фермент), CAT (каталаза), PTPN22 (протеинтирозинфосфатаза 22), MYG1 (экзонуклеаза MYG1). ), MITF (Микрофтальмия-ассоциированный фактор транскрипции), KIT (протоонкоген), ESR 1 (рецептор эстрогена 1), AIRE (аутоиммунный регулятор), COMT (катехол-О-метилтрансфераза), NALP1 (кодирует ключевой регулятор системы врожденного иммунитета, который стимулирует опосредуемые интерлейкином-1-бета воспалительные и апоптотические пути патогенеза в ответ на неизвестные бактериальные или вирусные триггеры), FAS (апоптозный антиген), EDN1 (эндотелин 1), COX2 (циклооксигеназа 2), VIT1 (вакуолярный переносчик железа 1), IKZF4 (цинковый палец 4 семейства IKAROS), и DDR1 (Рецептор домена дискоидина 1).
В последнее время наблюдается все больше доказательств корреляции между аутоиммунными заболеваниями и полиморфизмом фактора роста эндотелия сосудов (VEGF). Фактор роста эндотелия сосудов (VEGF) является одним из первичных регуляторов ангиогенеза, изучаемых при различных хронических заболеваниях и онкологических заболеваниях. При витилиго наблюдалась значительная связь между генотипом GG и более старшим возрастом начала заболевания ( p = 0,04).
Аутоиммунная гипотеза
Генетические исследования подтверждают аутоиммунную гипотезу как ведущую в объяснении патогенетического механизма витилиго, поскольку около 85% генов предрасположенности к витилиго кодируют молекулы, участвующие во врожденном и адаптивном иммунитете и апоптозе.
Аутоиммунная теория также подтверждается ассоциацией витилиго с другими аутоиммунными заболеваниями, наличием у пациентов с витилиго органоспецифических антител и, косвенно, иммуномодулирующим характером терапии витилиго.
Кроме того, участие иммунитета в развитии витилиго подтверждается наблюдением, что у опухолевых субъектов, получавших ингибиторы контрольных точек, заболевание может развиваться. Таким образом, было замечено, что у пациентов с метастатической меланомой, получавших ингибитор гликопротеина цитотоксических T-лимфоцитов 4 (CTLA-4) и ингибитор белка запрограммированной клеточной смерти 1 (PD-1), увеличивалось количество Т-клеток, а развитие витилиго потенциально может привести к лучшему ответу на лечение и повышению уровня выживаемости.
Напротив, Miao et al., используя на трансгенных мышах модель витилиго с Т-клеточным рецептором белка меланоцитов Pmel-1, показали, что лиганд PD-L1 снижает количество чувствительных к меланоцитам Т-клеток, ингибирует активацию Vβ12-экспрессирующих Т-лимфоциты клетки и увеличивали количество Treg, обращая вспять депигментацию.
Было проведено несколько исследований на пробандах с витилиго и их родственниках, выявивших связь витилиго с иммуноопосредованными заболеваниями, такими как аутоиммунные заболевания щитовидной железы, болезнь Аддисона, пернициозная анемия, очаговая алопеция, ревматоидный артрит, псориаз, сахарный диабет и системная красная волчанка.
Одно из наиболее значимых исследований, в ходе которого было обследовано 2624 пробанда с витилиго, показало, что 19,4% пациентов (в возрасте > 20 лет) сообщали о наличии в анамнезе аутоиммунного заболевания щитовидной железы (чаще всего гипотиреоза), что в восемь раз больше, чем в 2,39% популяции.
Таким образом, в патогенезе витилиго принимают участие как врожденный, так и адаптивный иммунитет. Действительно, врожденные иммунные клетки, по-видимому, рано активируются эндогенными и экзогенными сигналами стресса, высвобождаемыми меланоцитами и кератиноцитами, что приводит к последующей активации адаптивного иммунного ответа, как гуморального, так и клеточно-опосредованного, вызывая целенаправленное аутоиммунное разрушение меланоцитов.
Меланоциты используют экзосомы, внеклеточные везикулы, содержащие миРНК, специфические для меланоцитов антигены, белки теплового шока и другие молекулы, действующие как молекулярные паттерны, ассоциированные с повреждением (DAMP), для передачи стресса на врожденную иммунную систему и, в частности, на дендритные клетки, которые функционируют как антигенпрезентирующие клетки.
Кластерная дифференцировка (CD)8+ Т-клеток имеет решающее значение для разрушения меланоцитов при заболевании витилиго. Эти клетки были выделены в больших количествах из крови пораженных мест и рядом с ними. Кроме того, их количество, по-видимому, коррелирует с активностью заболевания. Антигены, на которые нацелены эти аутореактивные меланоцит-специфические цитотоксические лимфоциты, происходят из белков меланогенного пути, таких как gp100 (антиген меланомы, распознаваемый Т-клетками 1), MART1, тирозиназы и родственных тирозиназе белов 1 и 2, таким образом опосредуя разрушение меланоцитов.
CD8+ T-клетки продуцируют интерферон-γ (IFN-γ), который отвечает за рекрутирование CD8+ T-клеток в поврежденной коже посредством положительной обратной связи благодаря хемокиновому лиганду CXC 9 (CXCL9), CXCL10 и CXCL11, хемокинам, которые опосредуют возвращение Т-клеток к эпидермису. Эти хемокины действительно повышены в сыворотке крови и коже при витилиго и коррелируют с активностью и тяжестью заболевания.
IFN-γ связывается со своим рецептором клеточной поверхности (IFNgR), вызывая рекрутирование янус-киназы (JAK)-1 и JAK2, которые посредством фосфорилирования преобразователя сигнала и активатора транскрипции (STAT) приводят к транскрипции индуцируемые гены IFN-γ. Экспрессия JAK1 выше в пораженной коже пациентов с витилиго и коррелирует с более низким процентом выживших меланоцитов. Все эти данные подтверждают исследования терапии, нацеленной на JAK1 и JAK2.
Что касается гуморального иммунитета, у пациентов с витилиго были обнаружены повышенные сывороточные титры антител, направленных против меланоцитов (например, антитела к меланину А, к рецептору меланин-концентрирующего гормона 1 (MCHR1), к тирозиназе, к gp100 и к тирозингидроксилазе), которые не коррелируют с активностью витилиго, и их нельзя считать основным фактором патогенеза витилиго.
Гипотеза окислительного стресса
Окислительный стресс играет решающую роль в инициировании витилиго с разрушением меланоцитов.
Меланоциты, которые подвергаются воздействию ультрафиолетового (УФ) излучения и химических загрязнителей, более восприимчивы как к избыточной продукции, так и к неадекватной очистке активных форм кислорода (АФК) в ответ на стресс. Это приводит к значительному изменению окислительного/антиоксидантного баланса. Примечательно, что наблюдается увеличение прооксидантов, таких как малоновый диальдегид и ксантиноксидаза, и снижение антиоксидантов, таких как каталаза, глутатионредуктаза, глутатионпероксидаза и супероксиддисмутазы.
Эндогенный и экзогенный стресс может спровоцировать избыточное образование АФК. Экзогенные стрессоры включают триггеры окружающей среды (например, ультрафиолетовое излучение, цитотоксические химические вещества и травмы); лекарства (например, наркотики, гормоны и вакцинация); и внутренние расстройства (злокачественные новообразования, инфекции, нервные расстройства и дисбаланс кальция). И, наоборот, чрезмерное производство АФК может быть вызвано внутренними стимулами, такими как меланогенез, энергозатратный процесс, который требует большого количества АТФ и аномального митохондриального энергетического метаболизма.
В самом деле, продукция значительного количества белков во время меланогенеза увеличивает риск неправильной укладки белков, вызывая активацию реакции развернутых белков (UPR). XBP1, кодирующий X-box-связывающий белок 1, является одним из важнейших компонентов UPR, который запускает выработку иммунных медиаторов, таких как IL-6 и IL-8, которые останавливают Treg и рекрутируют другие популяции иммунных клеток.
H 2 O 2 индуцирует выработку временного рецепторного потенциального катионного канала подсемейства M члена 2 (TRPM2), кальциевого канала, чувствительного к окислительному стрессу, что приводит к увеличению потока митохондриального кальция, таким образом, вызывая митохондриально-зависимый апоптоз меланоцитов.
Меланоциты, по-видимому, одновременно являются инициаторами и жертвами окислительного стресса. Меланоциты пациентов с витилиго более восприимчивы к окислительному стрессу, чем у пациентов без витилиго. Эта концепция подтверждается тем фактом, что меланоциты пациентов с витилиго демонстрируют большие трудности с культивированием ex vivo, чем у здоровых людей, а также более низкой антиоксидантной способностью у пациентов с витилиго, заключающейся в снижении глутатионпероксидазы, по сравнению с людьми без витилиго.
У меланоцитов больного витилиго нарушен ядерныйфактор, связанный с эритроидом-2 (Nrf2), основной путь клеточной защиты от окислительного стресса. Было обнаружено, что транскрипционная активность Nrf2 значительно ниже в клеточной линии витилиго-меланоцитов, чем в нормальных меланоцитах человека. Известными активаторами Nrf2 являются диметилфумарат (ДМТ) и афамеланотид. ДМТ увеличивает локализацию Nrf2 в ядре, а афамеланотид имитирует α-меланоцит-стимулирующий гормон (α-MSH), который может увеличивать количество Nrf2, что представляет собой многообещающую терапевтическую стратегию
На мышиной модели было показано, что накопление АФК также приводит к нарушению процесса аутофагии, состоящего из деградации поврежденных органелл и белков, необходимых для поддержания клеточного гомеостаза.
Окислительно-восстановительный дисбаланс характеризуется истощением глутатиона, что, в свою очередь, вызывает H2O2- индуцированное снижение синтеза PGE2. Следовательно, аналоги простагландинов могут быть благоприятным альтернативным лечением для пациентов с витилиго.
Наконец, окислительный стресс, по-видимому, частично связан с феноменом Кёбнера при витилиго. Хроническое трение приводит к высвобождению медиаторов воспаления, что приводит к увеличению АФК и дефектам адгезии в меланоцитах. Более того, эпителиальная травма индуцирует высвобождение IFNα, что, в свою очередь, увеличивает экспрессию CXCL10, способствуя миграции циркулирующих лимфоцитов в кожу.
Другим важным механизмом, при котором окислительный стресс может способствовать возникновению витилиго, является потеря дендритов меланоцитов, что приводит к нарушению переноса меланина в кератиноциты. Так, существуют исследования, показывающие, что α-MSH, используемый при лечении витилиго, защищает от H2O2- индуцированной потери дендритов в меланоцитах за счет активации пути mTORC1 (мишень рапамицинового комплекса 1 млекопитающих), который ингибируется рапамицином.
Однако эти исследования были опровергнуты последующими исследованиями, в которых ингибирование пути mTOR было полезным для индукции повторной пигментации витилиго. Похоже, что, подобно красной волчанке, путь mTOR отвечает за истощение Treg, и, следовательно, ингибирование этого пути может иметь преимущества при терапевтическом лечении пациентов. Действительно, рапамицин, ингибитор передачи сигналов PI3Kakt (фосфатидилинозитол-3-киназа)-mTORC1, по-видимому, увеличивает количество Treg-лимфоцитов у мышей h3TA2, останавливая процесс депигментации при витилиго. Клиническое исследование фазы 2 (идентификатор ClinicalTrials.gov: NCT05342519 ) в настоящее время проводится для оценки эффективности местного применения 0,1% рапамицина при витилиго.
Нейрогуморальная гипотеза
Нейрогуморальная гипотеза указывает на то, что нейрохимические медиаторы, секретируемые окончаниями кожных нервов, ответственны за цитотоксическое повреждение и гибель меланоцитов. Несколько клинических наблюдений подтверждают эту связь между нервной системой и кожей.
Во-первых, почти дерматомальное распределение пятен витилиго при сегментарном типе и симметричное при несегментарном. Фактически, при сегментарном типе витилиго ограничивается одним сегментом тела, но редко бывает строго дерматомальным, а распространяется на соседние дерматомы.
Кроме того, описано развитие витилиго у пациентов с поперечным миелитом, диабетической невропатией и в демаркированных областях после повреждения нерва.
Наконец, сильный эмоциональный стресс может спровоцировать появление или обострение витилиго. Механизм до сих пор не ясен; однако было постулировано увеличение нейроэндокринных гормонов и нейропептидов, увеличение окислительного стресса и модификация системы иммунной толерантности как потенциальные процессы, ведущие к депигментации.
Нейрогуморальная гипотеза подтверждается несколькими открытиями, касающимися роли симпатической нервной системы, нейропептидов и морфологических изменений кожных нервов.
На выработку меланина, по-видимому, влияет дисфункция вегетативной нервной системы, заключающаяся в повышенном адренергическом тонусе и сниженном парасимпатическом тонусе, что увеличивает дермальный кровоток при сегментарных поражениях витилиго в три раза по сравнению с нормальной кожей. Кроме того, у пациентов с витилиго наблюдается повышенный уровень норадреналина в плазме и повышенная концентрация катаболитов катехоламинов в моче, что связано с активностью заболевания. Катехоламины вызывают вазоконстрикцию, гипоксию и гиперпродукцию АФК, что приводит к гибели меланоцитов.
Нейропептид Y (NPY), связанный со стрессом, увеличивается в пораженной витилиго коже и коже вокруг нее.
Витилиго также связано со значительно повышенным уровнем фактора роста нервов (NGF), который также активируется стрессом.
Наконец, исследование под электронным микроскопом дермальных нервов кожи с витилиго показало структурные изменения, такие как увеличение толщины базальной мембраны шванновских клеток и незначительную дегенерацию аксонов.
Терапия витилиго
Лечение витилиго до сих пор остается одной из самых сложных дерматологических проблем. Признание того, что витилиго — это не только косметическое заболевание, и что существуют эффективные и надежные методы лечения, является важным первым шагом в лечении этого состояния.
Методы лечения, которые включают хирургическое вмешательство, местные и системные иммунодепрессанты и фототерапию, могут работать вместе, чтобы замедлить прогрессирование состояния, стабилизировать депигментированные поражения и способствовать репигментации.
Терапия лучше всего работает на лице, шее, туловище, тогда как губы и дистальные отделы конечностей менее чувствительны. Репигментация сначала развивается по краям поражений или перифолликулярно. Лечение должно проводиться не менее двух-трех месяцев, чтобы оценить его эффективность.
Поскольку большинство вариантов лечения требуют много времени и длительного наблюдения, ведение требует индивидуальной терапевтической стратегии.
Косметолог должен проконсультировать лиц с поражениями открытых участков кожи, относительно их маскировки косметическими средств. К ним относятся препараты для автозагара с использованием дигидроксиацетона, которые обеспечивают стойкий цвет до нескольких дней, и тонирующей косметики.
Медикаментозная терапия
С 1950-х годов местные кортикостероиды использовались из-за их способности уменьшать воспаление и модулировать иммунную систему. Не проводилось исследований, определяющих идеальные временные рамки для использования местной терапии кортикостероидами. Одни авторы советуют использовать его каждый день в течение двух-трех месяцев, другие советуют применять интермиттирующую стратегию.
Топические ингибиторы кальциневрина и местные кортикостероиды часто используются в качестве стандартной терапии некоторых типов витилиго. Топические ингибиторы кальциневрина обычно используются два раза в день.
Кортикостероиды подавляют клеточный иммунный ответ и разрушение меланоцитов, одновременно стимулируя регенерацию меланоцитов и меланогенез. топические кортикостероиды являются основным методом лечения, локализованного витилиго, в то время как низкие дозы системных кортикостероидов используются для стабилизации быстро прогрессирующего заболевания. Топические ингибиторы кальциневрина (такролимус и пимекролимус) предпочтительнее кортикостероидов у пациентов с поражением лица или областей с высоким риском атрофии кожи
Согласно недавнему мета-анализу, терапевтические преимущества топических ингибиторов кальциневрина в сочетании с фототерапией были выше, что подтверждает синергетический эффект этого комбинированного лечения. Когда фототерапия невозможна, для лечения поражений шеи и лица может быть полезна местная монотерапия ингибиторами кальциневрина, особенно у детей. Другой метаанализ показал, что, за исключением области шеи и лица, добавление топических ингибиторов кальциневрина к терапии узкополосным ультрафиолетом B (NB-UVB) не приводило к существенно лучшим результатам по сравнению с монотерапией узкополосным ультрафиолетом B.
Немедикаментозная терапия [6]
Различные типы лазеров, используемые как в качестве монотерапии, так и в качестве комбинированной терапии, эффективны при лечении витилиго. Способ действия этих лазеров разнообразен и включает фотобиомодуляцию для репигментации (эксимерные лазеры), фотоабляция для подготовки участка реципиента перед трансплантацией (абляционные лазеры), стимуляция тканей для повышения эффективности фототерапии (фракционные лазеры) и фотомеханическое взаимодействие с депигментированными участками (Q‐switched лазеры).
Эксимерный лазер
Эксимерный лазер (ЭЛ) с длиной волны 308 нм, прибор для направленной фототерапии, был впервые описан в 2002 году для репигментации при витилиго. ЭЛ излучает когерентный и монохроматический свет с длиной волны 308 нм и считается более эффективным при витилиго, чем узкополосный УФ-В (NB-UVB) с длиной 311 нм. Он показан при депигментации менее 10% поверхности тела и не влияет на окружающую кожу. Подобно NB-UVB, ЭЛ ингибирует воспаление и индуцирует апоптоз Т-клеток. Кроме того, ЭЛ индуцирует дифференцировку стволовых клеток меланоцитов, стимулирует выработку меланина, а также пролиферацию и миграцию меланоцитов, вызывающих репигментацию. Имеются убедительные доказательства, демонстрирующие эффективность ЭЛ при лечении несегментарного витилиго.
Эффективность ЭЛ сравнивалась с эксимерной лампой 308 нм и NB-UVB 311 нм в двух мета-анализах. На основании трех рандомизированных контролируемых испытаний (РКИ) метаанализ не обнаружил различий между ЭЛ и эксимерной лампой в достижении ≥ 50% и ≥ 75% площади репигментации. Точно так же не было обнаружено различий у пациентов, достигших ≥ 75% и 100% площади репигментации между ЭЛ и NB-UVB в метаанализе, основанном на четырех РКИ. Тем не менее, ЭЛ был более эффективным, чем NB-UVB, при оценке ≥ 50% площади репигментации в качестве исхода. В другом исследовании оценивались пациенты с несегментарным витилиго, получавшие либо ЭЛ, либо NB-UVB после пункционной пластики, и не было обнаружено существенной разницы в репигментации.
Калькулятор витилиго – инструмент, помогающий определить степень заболевания витилиго. Калькулятор оценивает процент поражения от площади поверхности тела (BSA) или степень поражения для каждой области (от 0 до 6 баллов).
Три РКИ показали улучшения для ≥75% площади репигментации, когда ЭЛ сочетался с местным применением такролимуса по сравнению с монотерапией ЭЛ. Это соответствовало Кокрейновскому обзору лечения витилиго о сочетании фототерапии NB-UVB с топическим лечением. Более того, РКИ с участием 233 детей с витилиго показало лучшие результаты после двенадцати недель лечения комбинированной терапией ЭЛ и иммуносупрессантами (такролимус, пимекролимус или галометазон) по сравнению с монотерапией EL. Ву и др.сравнили монотерапию ЭЛ с местной монотерапией 0,1% такролимуса и не обнаружили различий в ≥ 50% площади репигментации через 6 месяцев.
Недостаточно данных об оптимальном режиме терапии ЭЛ. Одно рандомизированное исследование показало, что циклический график (два месяца, два раза в неделю, месячный интервал) одинаково эффективен по сравнению с непрерывным графиком ЭЛ два раза в неделю. Более того, не было обнаружено существенных различий между одним, двумя или тремя сеансами в неделю. Однако репигментация шла несколько быстрее при трех сеансах в неделю. Оптимальный протокол восстановления пигментации подразумевает минимум 20 процедур.
Недостатками ЭЛ являются высокие затраты на приобретение и обслуживание, ограниченная доступность и трудоемкость процедур. Преимущества ЭЛ включают более низкую общую кумулятивную дозу УФ-излучения по сравнению с NB-UVB, отсутствие воздействия на неповрежденную кожу и высокую эффективность, особенно в сочетании с ингибиторами кальциневрина.
Таким образом, комбинация эксимерной терапии с местной иммуносупрессивной терапией рекомендуется при локализованном, несегментарном и сегментарном витилиго. Безопасность этой терапии была недавно продемонстрирована на большой когорте из 25 694 пациентов с витилиго. Однако при активном витилиго с BSA > 10% отдавалось предпочтение комбинации пероральной мини-импульсной терапии и NB-UVB.
Рисунок 3. Фолликулярная репигментация. При слиянии пятен участки витилиго почти заполнились, но они более плотные, чем окружающая нормальная кожа. Меланоциты могут сохраняться в эпителии волосяных фолликулов и служить для повторного заселения пораженной кожи, с помощью фотохимиотерапии или фототерапии с длиной волны 312 нм.
Рисунок 4. Полная репигментация, индуцированная фотохимиотерапией
Лазеры для депигментации при витилиго
Если депигментация не поддается лечению, а площадь, пораженная заболеванием, слишком большая (универсальное витилиго), пациенты могут захотеть депигментировать остаточную пигментированную кожу и тем самым улучшить качество жизни.
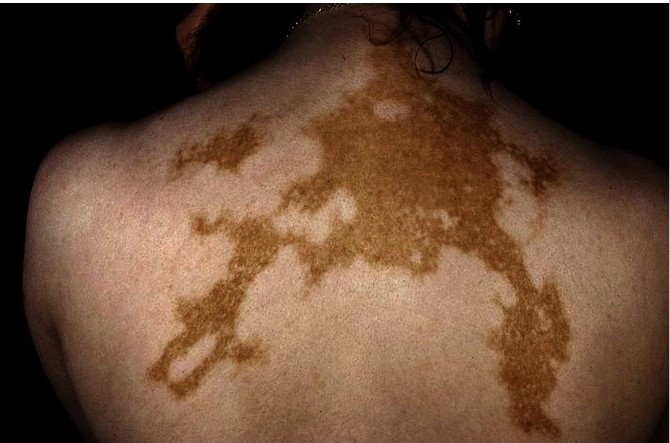
Рисунок 6. Универсальное витилиго на спине © Springer Science+Business Media
Местное отбеливание монобензиловым эфиром гидрохинона (MBEH), фенольные пилинги, криотерапия и лазеры эффективно используются в качестве депигментирующего лечения. Топическое отбеливание связано с такими ограничениями, как раздражение кожи, ограниченная доступность, а также неполный и медленный клинический ответ на терапию. Для сравнения, лазеры относительно безопаснее и действуют быстрее.
Как правило, для депигментационной терапии использовались наносекундные лазеры с модуляцией добротности (QS) с различными длинами волн (532, 694, 755 нм). Доказательства эффективности пикосекундных лазеров в отношении депигментации пока отсутствуют. Наносекундные лазеры QS излучают импульсы с высоким поглощением меланином и очень короткой длительностью, в пределах наносекундного диапазона, чтобы соответствовать времени тепловой релаксации меланосом. Это приводит к фотомеханическому взаимодействию лазера с тканью, что приводит к избирательному повреждению меланоцитов.
QS-лазер на иттрий-алюминиевом гранате, легированном неодимом, с удвоенной частотой (QS Nd:YAG)
Маджид и др. исследовали эффективность лазера QS Nd:YAG с длиной волны 532 нм в проспективном открытом исследовании. Пятнадцать пациентов с > 80% площади депигментации были пролечены 1-3 раза. 13 из 15 пациентов достигли ≥ 90% площади депигментации, и только один пациент сообщил о рецидиве через 3 месяца наблюдения. Кроме того, РКИ с участием 40 пациентов показали улучшение состояния лица у пациентов с активным витилиго при использовании лазера QS Nd:YAG по сравнению с пилингом ТСА. Длительная депигментация после лазера QS Nd:YAG оценивалась в ретроспективном исследовании с участием 28 пациентов. После периода наблюдения в течение 2–5 лет 85 % пациентов были очень довольны, а у 89,3 % сохранялась площадь депигментация > 90 %.
Рубиновый лазер QS (QSRL)
Тиссен и др . добились полной депигментации у всех 8 пациентов после 1 сеанса с использованием QSRL.Однако, у 5 пациентов развилась фолликулярная репигментация в течение 9 месяцев наблюдения. Остальные 3, все с изначально положительным феноменом Кёбнера, сохранилось отсутствие пигмента на обработанных участков. В ретроспективном исследовании с участием 27 пациентов также оценивалась долгосрочная эффективность QSRL после достижения полной депигментации. В то время как только у половины пациентов наблюдалась > 75% площадь депигментация в течение периода наблюдения 13 месяцев, многие пациенты (85%) были удовлетворены лечением. Другое ретроспективное исследование на девяти пациентах, получавших QSRL, выявило рецидив почти у половины пациентов через 2–18 месяцев.
Александритовый лазер QS (QSAL)
Ван Гил и др. сравнили действие криотерапии и 755 нм александритового лазера у 22 пациентов и не обнаружили существенной разницы в разрушении пигментации (46,7% против 42,9%). Однако побочные эффекты наблюдались только у группы, получавшей криотерапию.
Кроме того, ретроспективное исследование с участием шести пациентов с 16 участками нормально пигментированной кожи (с поражением BSA 5-15%) лечили двумя сеансами рубиновым QS-лазером с длиной волны 694 нм, александритовым QS-лазером с длиной волны 755 нм или Nd:Yag-лазером QS с длиной волны 532 нм до полной депигментации. У двух третей пациентов наблюдался рецидив в среднем после 36 месяцев с момента лечения.
Таким образом, лазерная терапия депигментации оказалась безопасным методом лечения с высоким уровнем удовлетворенности пациентов. Краткосрочные побочные эффекты являются общими и включают: пурпуру, корки, повреждение мелких сосудов кожи, но о долгосрочных побочных эффектах или рубцах не сообщалось. Кроме того, преимущество лазерной терапии заключается в том, что ее воздействие ограничивается участком лечения, в то время как местное лечение эфиром гидрохинона вызывает депигментацию не только в местах лечения. Однако лазерная депигментация является болезненной процедурой, для которой часто необходима местная анестезия. Терапия также занимает много времени, ограничивая область лечения. Долгосрочные результаты сильно различаются и их трудно предсказать, кроме того, в большинстве случаев требуются поддерживающие сеансы не реже одного раза в год.
Лазеры, используемые перед трансплантацией меланоцитов
Существует несколько методов, используемых для подготовки места реципиента при трансплантации аутологичных некультивируемых меланоцитов, таких как жидкий азот, дермабразия, псорален, ультрафиолет А, аспирация и лазеры. Подготовка реципиентного участка имеет важное значение, поскольку она влияет на прилегание трансплантата меланоцитов, питательную поддержку трансплантата, конечную скорость репигментации, эстетический результат и связанные с трансплантацией осложнения. Лазеры, в отличие от других методов подготовки участка реципиента, можно использовать на больших площадях, деликатных участках, таких как рот, нос и веки, не повреждая окружающую кожу.
Короткоимпульсный углекислотный (CO 2 ) лазер для подготовки реципиента
Короткоимпульсный СО2 –лазер производит короткие импульсы высокоэнергетического излучения с длиной волны 10 600 нм, производя быструю абляцию ткани с минимальным кровотечением. Кроме того, он вызывает меньшее термическое повреждение окружающих тканей по сравнению с более традиционными CO 2 -лазерами с непрерывной волной, которые имеют более высокий риск рубцевания. Обработка таким короткоимпульсным CO 2 -лазером и сканером места сепарирования приводила к > 80% площади репигментации в нескольких исследованиях. В открытом сравнительном исследовании при стабильном витилиго сравнивались результаты репигментации при механической дермабразии и терапию короткоимпульсным CO2- лазером (плотность 82%, глубина 209 мкм) для подготовки участка реципиента. В целом дермабразия показала лучшую репигментацию, хотя у одного пациента развились гипертрофические рубцы и атрофия в месте дермабразии.
Эрбиевый лазер YAG (Er:YAG) для подготовки реципиента
Лазер на иттрий-алюминиевом гранате, легированном эрбием (Er:YAG), излучает волну длиной 2 940 нм, которое поглощается водой примерно в 10 раз сильнее, чем излучение CO2, что снижает термические повреждения и риск образования рубцов. Gupta et al. оценивали использование лазера Er:YAG по сравнению с механическим дермабразивным аппаратом при подготовке реципиентного участка в РКИ с участием 32 пациентов. Никакой разницы в репигментации или нежелательных явлениях не наблюдалось.
Лагранж и др. сравнил микронидлинг с лазером Er:YAG в РКИ с участием 6 пациентов. У трех пациентов наблюдалась > 75% площади репигментация, в то время как ни у одного из них не было достигнуто репигментации с помощью микронидлинга.
Наконец, долгосрочное ретроспективное исследование с участием 714 пациентов показало, что у механической дермабразии частота рецидивов ниже, чем у лазера Er:YAG.
Фракционный лазер CO 2 для подготовки реципиента
В РКИ сравнивали поверхностную абляцию (144 мкм), глубокую абляцию (209 мкм) и фракционную абляцию (225 мкм) с отрицательным контролем в качестве предварительной обработки перед трансплантацией клеточной суспензии. Более 75% площади репигментации было выявлено в 40%, 50% и 0% случаев поверхностной, глубокой и фракционной абляции соответственно. Авторы пришли к выводу, что поверхностная абляция эффективна, в то время как фракционная абляция неэффективна для подготовки реципиентного участка.
Таким образом, абляционные лазеры, по-видимому, обеспечивают быстрое и равномерное обнажение эпидермиса с благоприятными результатами репигментации для подготовки участка-реципиента. Для подготовки донорского участка следует использовать только импульсные лазеры из-за риска образования рубцов при использовании лазеров непрерывного действия.
Терапия витилиго обогащенной плазмой [7]
Обогащенная тромбоцитами плазма (PRP) представляет собой аутологичный препарат концентрированной плазмы, содержащий различные факторы роста. Эти факторы роста гипотетически могут стимулировать меланоциты. Тем не менее, лечение витилиго только обогащенной тромбоцитами плазмой может быть неэффективным. Согласно исследованию, богатая тромбоцитами плазма и NB-UVB в сочетании с терапией давали лучшие результаты, чем только NB-UVB. Следовательно, богатая тромбоцитами плазма может более эффективно вылечить витилиго при использовании в сочетании с другими методами лечения.
Кроме того, большое количество инъекций, расположенных близко друг к другу, представляют собой неприятную процедуру и могут способствовать возникновению эффекта Кёбнера.
Учеными Марием Рекик et al было проведено проспективное исследование в период с января 2019 года по сентябрь 2021 года.
Исследование включало 10 пациентов с витилиго, рефрактерным к традиционным методам лечения. Средний возраст составил 36,2 года. До лечения обогащенной тромбоцитами плазмой витилиго было стабильным во всех случаях. Среднее количество сеансов обогащенной тромбоцитами плазмы, полученных пациентами, составило 2,6 (1-6). Видимое улучшение поражений было получено в среднем после 1,5 сеансов. У 40% пациентов наблюдалась репигментация более чем на 50% по крайней мере для одного участка поражения. Улучшение более чем на 75% (4 степень) было отмечено в 2 случаях после средней продолжительности 5,5 сеансов. У 40% пациентов наблюдалась репигментация более чем на 50% по крайней мере для одного поражения. Процент улучшения от 50 до 74% (степень 3) был получен у 2 пациентов. У четырех пациентов улучшение составило менее 25% (1 степень) после в среднем 1,75 сеансов.
Таким образом, серия исследований доказывает пользу обогащенной тромбоцитами плазмы при лечении витилиго. Это безопасный и многообещающий вариант лечения стабильных поражений различных участков тела с небольшим количеством побочных эффектов.
Хирургическое лечение [1]
Хирургические методы являются эффективными для пациентов со стабильным витилиго, при неэффективности медикаментозного лечения. Хирургические процедуры направлены на замену меланоцитов из аутологичной донорской кожи с нормальной пигментацией. Обязательным условием успешной репигментации является правильный отбор пациентов. В принципе, данный метод показан при всех стабильных формах (отсутствие активности заболевания в течение от 6 месяцев до 4 лет) сегментарного и очагового витилиго при отсутствии в анамнезе феномена Кёбнера и тенденции к келоидному типу рубцеванию, если традиционная терапия оказалась неэффективной Методы трансплантации обычно сочетаются с другими методами лечения, включая фототерапию (ПУВА-терапия), узкополосное УФВ (NBUVB), местные иммуносупрессоры и лечение эксимерным лазером для улучшения репигментация.
Традиционный метод пересадки кожи
Трансплантация эпидермального слоя представляет собой первый хирургический метод лечения витилигинозных пятен. Данный клинический опыт при использовании культур эпидермальных клеток на ожогах и хронических незаживающих ранах перенесли на пациентов с витилиго, получив хорошую репигментацию и удовлетворительное цветовое соответствие с окружающей кожей.
Мини- или панч-пересадка
Данный метод является одним из наиболее часто используемых техник, поскольку он экономичен и прост в выполнении даже с минимальным оборудованием. Биопсийный материал размером 1-2 мм берутся из донорской непораженной кожи для трансплантации в депигментированную область. . Иммуногистохимический анализ биоптатов, собранных в репигментированной коже пациентов с витилиго в разные моменты времени после процедуры панч-пересадки, показал, что меланоциты легко перемещаются от краев пересаженной кожи к депигментированным областям реципиента.
Эпидермальная пересадка
Эпидермальная пересадка используется для получения очень тонких кожных трансплантатов путем расщепления дермо-эпидермального соединения. При использовании данного метода из эпидермиса создается пузырь на донорском участке, с которого хирургическим путем удаляют покрышку и пересаживают на реципиентный участок. Как правило, пузырь получают путем негативного давления 300—500 мм рт.ст.. За один или два дня до трансплантации область реципиента подготавливают с помощью замораживания жидким азотом, абляционной лазерной дермабразии или аспирационных пузырей. Типичными осложнениями являются временная гиперпигментация или несоответствие цвета. Для ускорения репигментации можно применять дополнительную послеоперационную фототерапию NBUVB или PUVA .
Трансплантация расщепленного кожного лоскута
Основным место забора лоскута, как и при других хирургических техниках, чаще всего являются области бедер, ягодиц, спины, рук или предплечий. По толщине ткани, взятой для трансплантации, различают тонкие (0,15–0,3 мм), промежуточные (0,3–0,45 мм) и толстые (0,45–0,75 мм) трансплантаты. Ультратонкие трансплантаты (0,08–0,15 мм) также используются с удовлетворительными результатами. Ультратонкий кожный лоскут не удерживается реципиентным участком, вероятно, из-за полного отсутствия дермальной ткани и обычно отпадает через 2 недели, оставляя равномерную пигментацию.
Трансплантация волосяного фолликула
Предшественники меланоцитов в коже локализуются в такой части фолликула – как выпуклость со стволовыми клетками.
Клинические наблюдения и экспериментальные данные привели исследователей к выводу, что репигментация кожи при витилиго происходит главным образом из меланоцитов волосяных фолликулов. Происходит это либо спонтанно, либо после УФ-терапии или других методов лечения. В связи с этим, большое внимания уделяется пересадке волосяных фолликулов. Фолликулярные стволовые клетки меланоцитов сохраняются в защищенном от иммунитета месте вдали от поверхности кожи, что предполагает их меньшую склонность к преждевременному истощению.
Чтобы получить волосяные фолликулы для трансплантации, необходимо собрать небольшие фрагменты кожи, обычно с волосистой части головы. Затем фолликулы отделяют и окончательно пересаживают в предварительно сформированные лунки, расположенные через равные промежутки 3–5 мм в зоне поражения. Адъювантное лечение предполагает использование ингибиторов кальциневрина, кортикостероидов или фотохимиотерапии псораленом и естественное пребывание на солнце.
Клеточная трансплантация [1]
В отличие от тканевой пересадки, клеточная позволяет обрабатывать участок депигментированной кожи, значительно превышающий площадь забора.
Суспензия некультивируемых эпидермальных клеток
Процедура состоит из взятия небольшого фрагмента кожи с нормальной пигментацией, обычно из затылочной области. Затем кожу, полученную с донорского участка, подвергают ферментативному расщеплению для отделения эпидермиса от дермы, получая смешанную клеточную суспензию меланоцитов и кератиноцитов, готовую для инокуляции в реципиентную область. В протоколах трансплантации некультивируемых клеток меланоциты и кератиноциты трансплантируют в тот же день (горячая трипсинизация) или на следующий день (холодная трипсинизация). Долгосрочные исследования пациентов с витилиго, получавших трансплантаты некультивированных эпидермальных клеток, показали стабильную репигментацию в 93% случаев в среднем через четыре года.
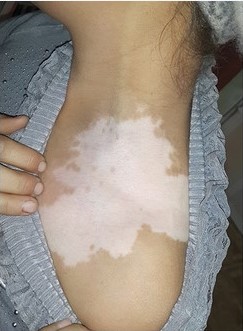
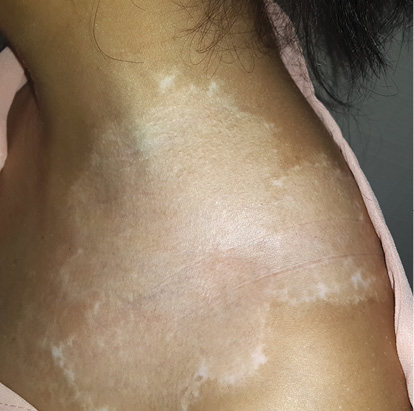
Рисунок 7. Очаг витилиго до и после трансплантации суспензии некультивированных эпидермальных клеток [9].
Трансплантация культивированных меланоцитов
Усовершенствование техники трансплантации эпидермальных клеток сделало возможным культивирование меланоцитов в среде, обогащенной различными факторами. После извлечения отдельных клеток из фрагментов кожи в кожу реципиента трансплантируют меланоциты, культивируемые в течение 3–4 недель. Исследования, сравнивающие методы трансплантации культивированных и некультивируемых меланоцитов, не являются окончательными, поскольку сообщалось об использовании различных временных конечных точек, худших косметических результатах и лучшей репигментации.
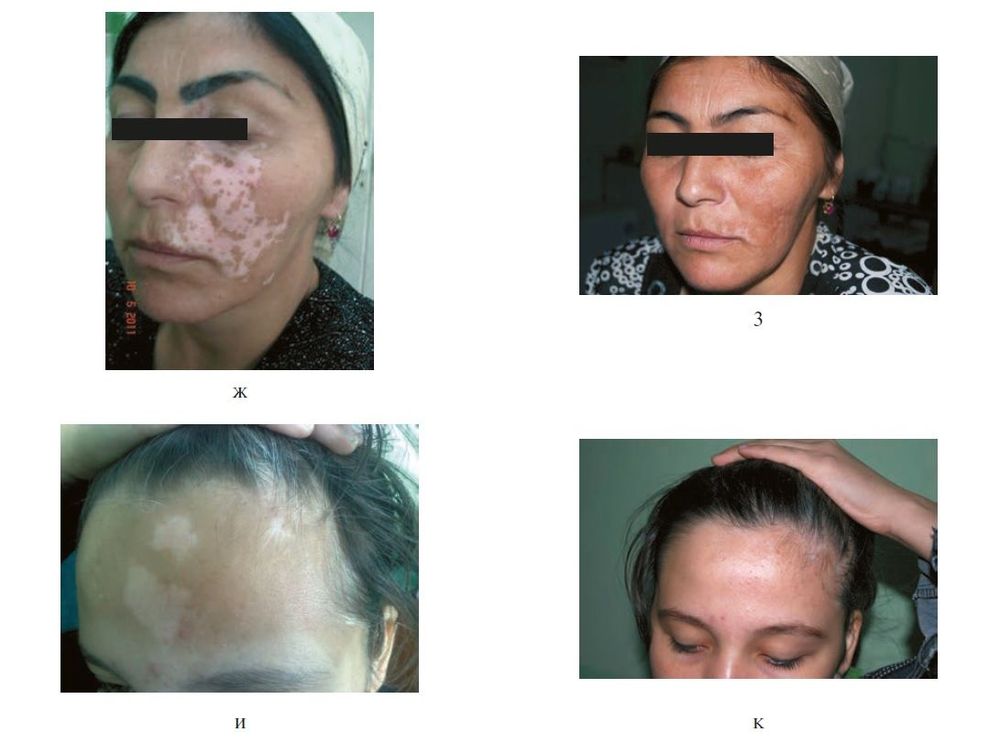
Рисунок 8. Клинические проявления витилиго до и после пересадки аутологичных некультивированных меланоцитов (продолжение). ж, з — больная Г.: состояние до (ж) и после (з) лечения; и, к — больная Д.: состояние до (и) и после (к) лечения. [10]
Некультивируемая суспензия клеток наружного корневого влагалища волосяного фолликула
Другой метод, позволяющий получать меланоциты и предшественники кератиноцитов, а также стволовые клетки волосяных фолликулов, основан на ферментативной экстракции единиц кожных фолликулов. Подготовка материала для прививки клеточной суспензии включает повторные циклы трипсинизации-нейтрализации. Превосходная репигментация с помощью некультивированной фолликулярной суспензии корневого влагалища была подтверждена несколькими исследованиями. Сравнительные испытания не выявили различий с точки зрения косметических результатов между некультивируемыми методами фолликулярного корневого влагалища и методами суспензии эпидермальных некультивируемых клеток. Для лучшего результата показано собирать волосы в фазе анагена с затылочной области головы, сохраняя целостность волосяных фолликулов. Участок, подлежащий лечению, обычно подготавливают с помощью дермабразии и на последнем этапе обрабатывают коллагеном.
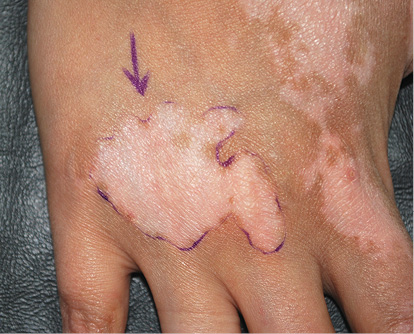
Рисунок 9. Очаги витилиго после трансплантации суспензии некультивированных эпидермальных клеток и клеток наружного корневого влагалища волосяных фолликулов [9]
Микронидлинг
Техника микронидлинга подразумевает использование очень тонких иглы для создания микротравм на коже, вызывая репаративные/регенеративные процессы, подобные реакции заживления ран, с сопутствующей продукцией цитокинов и митогенного фактора, включая пропигментарные фактор. Метод в основном используется для омоложения кожи. Кроме того, процедура микронидлинга облегчает проникновение лекарств через роговой слой. В двух разных исследованиях сообщалось об эффективной репигментации с использованием микронидлинга в сочетании с 5-фторурацилом. Однако в другом исследовании микронидлинг в сочетании с фототерапией NBUVB, такролимусом и местным латанопростом не подтвердил терапевтический эффект. Микроканалы, созданные с помощью микронидлинга, можно использовать для доставки клеток в процессе трансплантации, повышая их выживаемость и персистенцию.
Ингибиторы янус-киназ [4]
Семейство янус-киназ Janus из JAK1, JAK2, JAK3 и TYK2, которые участвуют в важном пути JAK/STAT, проявляя плейотропные эффекты при передаче множественных внеклеточных сигналов, участвующих в регуляции пролиферативной передачи сигналов, дифференцировки, миграции и апоптотических свойств.
Не существует лицензированных ингибиторов JAK/STAT для лечения дерматологических проблем, однако некоторые из них (руксолитиниб и тофацитиниб) используются для лечения других состояний, таких как миелофиброз и ревматоидный артрит. Тем не менее, использование этих препаратов не по прямому назначению при лечении витилиго показало многообещающие результаты.
Ингибиторы JAK-STAT способствуют передаче сигналов Sonic Hedgehog и Wnt при эпидермальной пигментации, при этом первые индуцируют миграцию, пролиферацию и дифференцировку меланоцитов.
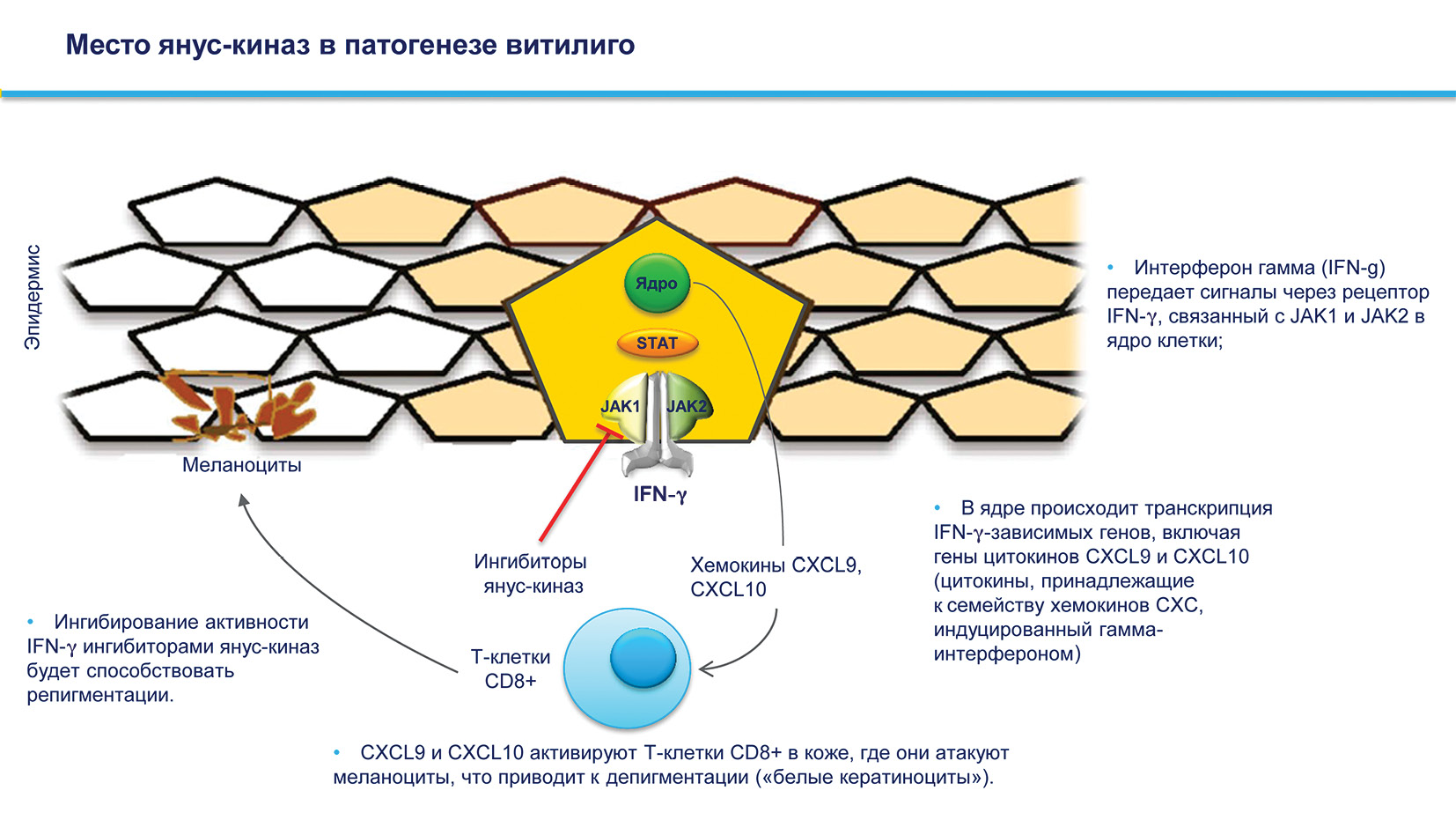
Рисунок 10. Место янус-киназ в патогенезе витилиго [11].
Тофацитиниб
Тофацитиниб — одобренный FDA ингибитор JAK1/3 для лечения ревматоидного артрита, псориатического артрита и язвенного колита.
Тофацитиниб в дозе 5-10 мг 1-2 р. в день продемонстрировал превосходную эффективность с коэффициентом улучшения 5,4% у 5/10 пациентов с областями, подвергшимися воздействию солнца, или областями, обработанными только фототерапиеи. Кроме того, после лечения тофацитинибом наблюдалось снижение количества CD8 + Т-клеток и хемокинов, таких как CXCL9 и CXCL10, но не наблюдалось изменений процентного содержания меланоцит-специфических Т-клеток.
Руксолитиниб
Руксолитиниб, первый якиниб, получивший одобрение FDA, представляет собой ингибитор JAK1/2, предназначенный для борьбы с истинной полицитемией и первичным миелофиброзом промежуточного и высокого риска.
Исследования показали, что помимо ингибирования JAK, руксолитиниб также ингибирует дифференцировку и миграцию дендритных при витилиго, усиливая ответы цитотоксических Т-клеток CD8 . В двойном слепом исследовании 157 набранных пациентов с витилиго были рандомизированы в соотношении 1:1:1:1:1 для местного применения крема руксолитиниба 1,5% два раза в день, 1,5%, 0,5%, 0,15% один раз в день, в результате чего экспрессия CXCL9 и CXCL10 значительно снизилась в группах, получавших крем 1,5 % два раза в день, 1,5 % один раз в день и 1,5 % один раз в день, а также у большего числа людей в группах, получавших крем руксолитиниб 1,5 % два раза в день и 0,5 % один раз в день, с достижением F-VASI50. , во время которого группа 1,5% BID дала самые высокие ответы.
Барицитиниб
Барицитиниб является селективным ингибитором JAK1/2, который ингибирует сигнальную передачу многочисленных провоспалительных цитокинов, одобренный для лечения ревматоидного артрита. Насколько известно, был только один случай, описывающий репигментацию у пациентов с витилиго, принимавших барицитиниб в дозе 4 мг в день для лечения ревматоидного артрита. Кроме того, в настоящее время проводится исследование 2 фазы ( NCT04822584 ), в котором пациенты получали комбинированную терапию барицитинибом 4 мг/сут и фототерапией.
Ифиданцитиниб (ATI-50002)
Ифиданцитиниб является еще одним двойным ингибитором JAK1/3 для лечения очаговой алопеции, который в настоящее время проходит фазу 2 клинических испытаний для его применения при лечении витилиго. У пациентов с несегментарным витилиго лица ( NCT03468855 ), получавших местно ATI-50002 два раза в день в течение 24 недель, наблюдались улучшенные показатели F-VASI и шкалы заметности витилиго (VNS).
Ритлецитиниб (PF-06651600) и брепоцитиниб (PF-06700841)
Ритлецитиниб, необратимый ингибитор JAK3 и тирозинкиназы, применимый для лечения ревматоидного артрита средней и тяжелой степени, и брепоцитиниб, ингибитор TYK2/JAK1. В настоящее время препараты проходят оценку их эффективности и профиля безопасности при активном НСВ в сочетании с фототерапией. ( NCT03715829 ).
Цердулатиниб (PRT062070)
Цердулатиниб, двойной ингибитор киназы SYK/JAK, прошел оценку ( NCT04103060 ) на предмет его безопасности и переносимости при местном лечении витилиго (0,37% гель церудулатиниба два раза в день).
Профилактика витилиго с помощью диеты и пищевых добавок[3]
Пищевые добавки и диета, богатая питательными веществами, могут рассматриваться как важные компоненты лечения витилиго.
Витамин B12 и фолиевая кислота
Витамин B12 (также известный как кобаламин) является одним из девяти водорастворимых витаминов и одним из восьми типов витамина B. Нормальное потребление B12 составляет 2,4 мкг в день. Было показано, что витамин B12 полезен для репигментации у пациентов, страдающих витилиго. Его необходимо включать в рацион, так как организм не может его синтезировать. Согласно оригинальному исследованию, проведенному в Бирмингемском медицинском центре Университета Алабамы, у 15 пациентов с диагнозом витилиго был низкий уровень витаминов B12 и B9. После введения в рацион восьми из этих пациентов витаминов B12 и B9 в течение трех лет наблюдалась репигментация.
Витамин C
Витамин С является одним из водорастворимых витаминов. В основном присутствует в цитрусовых, таких как лимон, киви, апельсины и зеленые листовые овощи. Витамин С должен быть частью сбалансированной диеты. Он обладает антиоксидантным действием и иммуномодулирующими характеристиками. Наружные формы витамина С не используется и противопоказан при лечении витилиго, поскольку он нарушает пути выработки меланина.
Витамин Д
Витамин D является жирорастворимым витамином, который поглощает такие вещества, как кальций и магний. 25-гидроксивитамин D₃ (кальцифедиол) действует на рецепторы дигидроксивитамина D3 на меланоцитах, инициируя секрецию меланина. Согласно исследованиям, уровень витамина D влияет на иммунную систему, поскольку иммунная система имеет ферменты/метаболиты, которые могут метаболизировать витамин D, что указывает на то, что иммунная система также способствует преобразованию неактивных форм витамина в активные формы кальцитриола. Из-за этого отношения к иммунной системе настоятельно рекомендуется включать его в терапию для лечения витилиго. Было проведено несколько исследований, чтобы понять влияние витамина D на пациентов с витилиго. Согласно пилотному исследованию Finamor et al., в котором приняли участие 16 пациентов, ежедневно в течение шести месяцев им регулярно вводили 35 000 МЕ (международных единиц) витамина D3. Из 16 у 14 пациентов наблюдалась репигментация от 25% до 75%, что свидетельствует о том, что добавление витамина D может замедлить прогрессирование заболевания.
Цинк
Более трех тысяч белков, таких как гормоны, ферменты и ядерные факторы, нуждаются в цинке в качестве кофактора для своего нормального функционирования. Супероксиддисмутаза, антиоксидант кожи, использует цинк в качестве кофактора фермента. Цинк также может ингибировать разрушение меланоцитов, поскольку апоптотические каспазы активируются, когда внутриклеточные концентрации цинка падают.
Полиподий лейкотомный
Вид папоротника под названием Polypodium leucotomos (PL) был исследован на предмет его значения для лечения ряда кожных заболеваний, особенно витилиго, псориаза, атопического дерматита, а также для предотвращения повреждения кожи, вызванного УФ-излучением. Были проведены исследования противовоспалительных, антиоксидантных, фотозащитных и иммуномодулирующих свойств PL. При использовании с фототерапией прием внутрь PL используется для повышения эффективности узкополосного УФ-В при лечении витилиго. Кроме того, было установлено, что сочетание PL с PUVA-терапией (псорален плюс ультрафиолетовое излучение-A) приводит к усилению репигментации. В группе, прошедшей PUVA вместе с PL, было больше участников, у которых была > 50% повторная пигментация, чем в группе, прошедшей PUVA с плацебо. У всех испытуемых наблюдалось успешное лечение их состояния после пятимесячной терапии Anopsos, который представляет собой водорастворимое липидное производное PL.
Хеллин
Хеллин представляет собой кристаллический экстракт растения Амми виснага , который используется в традиционной медицине по всему Средиземноморью. Перорально принимаемый активированный хеллин изучается как стимулятор меланогенеза и пролиферации культивируемых нормальных меланоцитов человека и клеток меланомы Mel-1. Он могжет играть роль в фотосенсибилизирующем лечении витилиго в сочетании с УФ-терапией. По сравнению с отсутствием лечения комбинация 4-процентного препарата хеллина для местного применения с монохроматическим эксимерным лазером (МЭЛ) с длиной волны 308 нм эффективно уменьшала депигментированные поражения. Хотя при сравнении фототерапии и фототерапии с топическим хеллином особой разницы в эффективности лечения не отмечено.
Глютен
Целиакия представляет собой аутоиммунное кишечное воспаление, характеризующуюся у людей с неблагоприятной реакцией на глютен. Согласно нескольким исследованиям, у людей с болезнью Крона витилиго активнее, чем у людей без данного заболевания. По сообщениям , пациенты с серопозитивной реакцией на глютен и аутоиммунными кожными заболеваниями , включая псориаз, дерматит, гепатит и витилиго, испытывали меньше симптомов после перехода на безглютеновую диету.
Фенилаланин
Предполагается, что аминокислота фенилаланин (Phe) действует как возможное лекарство от витилиго из-за ее решающей роли в регуляции катехоламинов, синтеза антител и, что наиболее важно, образования меланина. Они составляют основу аутоиммунной и неврологической патофизиологии витилиго. Фенилаланин гидроксилируется до тирозина, который затем используется в процессе меланогенеза. Фенилаланин и тирозин также принимают непосредственное участие в производстве катехоламинов. Согласно нейрогуморальной гипотезе, этиопатогенез витилиго прямо или косвенно связан с высвобождением катехоламинов вегетативными нервными окончаниями. Уровни фенилаланина или его метаболитов, которые нарушают выработку катехоламинов, могут влиять на возникновение или прогрессирование витилиго. Было проведено исследование, в котором после четырех месяцев лечения УФ-А испытуемые получали перорально фенилаланин (50 мг/кг) два раза в неделю в течение еще четырех месяцев. При введении фенилаланина вместе с облучением УФ-А у 94,7% людей наблюдалась фолликулярная репигментация, а у 26,3% — плотная репигментация.
Филлантус эмбелика
Исследования показали, что P. emblica обладает сильной антиоксидантной способностью благодаря высокому содержанию полифенолов и витамина С. Фрукты данного растения были дополнительно изучены на 130 субъектах в сочетании с каротиноидами и витамином Е, которые обычно используются при лечении витилиго. В исследовании 50% участников получали только традиционные методы лечения, включая фототерапию и местные лекарства. Вторая группа людей получала традиционную терапию, которая включала сочетание диетических антиоксидантов, витамина Е и каротиноидов три раза в день и лечение местными средствами или фототерапию. Согласно этим исследованиям, более высокий процент пациентов в группе, получавшей добавки с антиоксидантами, через шесть месяцев наблюдали незначительную репигментацию в области головы, шеи и ягодиц.
Пиперин
Исследования in vitro показали, что пиперин, основной алкалоид черного перца, стимулирует репликацию меланоцитов и вызывает развитие меланоцитарных дендритов. Исследования показали, что пиперин стимулирует взаимодействие УФ-излучения и меланоцитов.
Нигелла сатива
Nigella sativa — это многолетнее растение, дающее черный тмин, масляные изоляты которого часто используются для лечения ряда заболеваний, особенно дерматологических. Тимохинон, основной ингредиент Nigella sativa, тщательно исследуется как ключевой элемент, обладающий множеством преимуществ, в частности, в отношении его противораковых, иммуномодулирующих и противовоспалительных реакций. Было продемонстрировано, что местное применение масла Nigella sativa значительно снижает индекс оценки площади витилиго в течение четырех месяцев. Это может быть безопасным и эффективным дополнением к традиционной терапии витилиго.
Пуника гранатовая
Гранат ( Punica granatum Linn.) богат полифенольными химическими веществами и дубильными веществами. Таким образом, от трех до шести стаканов гранатового сока в день обеспечит восполнение необходимых антиоксидантов.
Зеленый чай
Он обладает значительной антиоксидантной активностью в качестве поглотителя ROS/RNS (активные формы кислорода/активные формы азота) в отношении обеспечения мощных противовоспалительных характеристик, которые могут модулировать опосредованный Т-клетками иммунологический ответ. В двух исследованиях in vitro было показано, что эпигаллокатехины оказывает сильное антиоксидантное воздействие на первичные меланоциты человека. Фактически, они снижали выработку АФК, восстанавливали нарушенную функцию митохондрий и снижали апоптоз. В дополнение к этому, эпигаллокатехины также контролировал пути, запускаемые окислительным стрессом, в меланоцитах, подвергшихся этому стрессу. Исследования демонстрируют иммуномодулирующие и ослабляющие окислительный стресс свойства крема с 2, 5 и 10% эпигаллокатехинов.
Куркумин
Основным встречающимся в природе липофильным полифенолом, присутствующим в корневище Curcuma longa (куркумы) и других видов куркумы, является куркумин, известный как диферулоилметан. Многочисленные исследования показали, что куркумин проявляет сильную антиоксидантную активность, что позволяет ему влиять на антиоксидантную систему как прямо, так и косвенно, а также ингибировать образование АФК и их внутриклеточных источников. Одно исследование in vivo показало, что при локальном сочетании узкополосного УФ-В (NB-UVB) и тетрагидрокуркуминоида на коже пациентов с витилиго скорость репигментации кожи была незначительно выше, чем при использовании только NB-UVB.
Источники:
1. Bellei B, Papaccio F, Picardo M. Regenerative Medicine-Based Treatment for Vitiligo: An Overview. Biomedicines. 2022 Oct 28;10(11):2744. doi: 10.3390/biomedicines10112744. PMID: 36359263; PMCID: PMC9687162.
2. Diotallevi F, Gioacchini H, De Simoni E, Marani A, Candelora M, Paolinelli M, Molinelli E, Offidani A, Simonetti O. Vitiligo, from Pathogenesis to Therapeutic Advances: State of the Art. Int J Mol Sci. 2023 Mar 3;24(5):4910. doi: 10.3390/ijms24054910. PMID: 36902341; PMCID: PMC10003418.
3. Dutta RR, Kumar T, Ingole N. Diet and Vitiligo: The Story So Far. Cureus. 2022 Aug 28;14(8):e28516. doi: 10.7759/cureus.28516. PMID: 36185835; PMCID: PMC9515252.
4. Feng Y, Lu Y. Advances in vitiligo: Update on therapeutic targets. Front Immunol. 2022 Aug 31;13:986918. doi: 10.3389/fimmu.2022.986918. PMID: 36119071; PMCID: PMC9471423.
5. Nimkar P, Wanjari A. Vitiligo and the Role of Newer Therapeutic Modalities. Cureus. 2022 Nov 2;14(11):e31022. doi: 10.7759/cureus.31022. PMID: 36475210; PMCID: PMC9717720.
6. Post NF, Ezekwe N, Narayan VS, Bekkenk MW, Van Geel N, Hamzavi I, Passeron T, Wolkerstorfer A. The use of lasers in vitiligo, an overview. J Eur Acad Dermatol Venereol. 2022 Jun;36(6):779-789. doi: 10.1111/jdv.18005. Epub 2022 Mar 1. PMID: 35176186; PMCID: PMC9314124.
7. Rekik M, Mseddi M, Kammoun N, Sellami K, Turki H. Efficacy of autologous platelet-rich plasma in the treatment of vitiligo: A 10-patient prospective study. J Cosmet Dermatol. 2022 Oct;21(10):4225-4233. doi: 10.1111/jocd.15050. Epub 2022 May 23. PMID: 35524443.
8. Vinardell MP, Maddaleno AS, Mitjans M. Melanogenesis and Hypopigmentation: The Case of Vitiligo. Indian J Dermatol. 2022 Sep-Oct;67(5):524-530. doi: 10.4103/ijd.ijd_1067_21. PMID: 36865864; PMCID: PMC9971791.
9. Сабиров У.Ю., Азимова Ф.В., Тоиров Б.А., Муминова С.Р. Оценка эффективности хирургического лечения витилиго методами меланоцитарной трансплантации на основе изучения экспрессии белка Wnt1. Клиническая дерматология и венерология. 2020;19(4):583‑587.
10. Сабиров У.Ю., Ибрагимов Ш.И. Хирургические методы лечения витилиго. Клиническая дерматология и венерология. 2013;11(1):84‑90.
11. Потекаев Н.Н., Петунина В.В., Жукова О.В., Аванесова В.И., Ткаченко С.Б. Путь JAK-STAT в патогенезе витилиго и применения ингибиторов янус-киназ в качестве терапии. Клиническая дерматология и венерология. 2022;21(1):8‑14.
прочитано
13253
раза